Polymérisation radicalaire
La polymérisation radicalaire est une polymérisation en chaîne qui comme son nom l'indique fait intervenir comme espèce active des radicaux.
Recherche sur Google Images :

Source image : sequence3d.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Un nouveau type de polymérisation radicalaire a vu le jour ces 20 dernières années qui permet d'obtenir des polymères possédant des architectures variés, ... (source : dcso.polytechnique)
- ... la polymérisation radicalaire contrôlée par les nitroxydes (NMP), la polymérisation... technique de polymérisation radicalaire vivante... (source : univ-ubs)
La polymérisation (par voie) radicalaire est une polymérisation en chaîne qui comme son nom l'indique fait intervenir comme espèce active des radicaux.
Elle est constituée de trois étapes simultanées :
-
- L'amorçage
- La propagation
- la terminaison
Du transfert a aussi lieu.
Caractéristiques
Le centre actif qui propage est un radical avec une structure quasi plane, l'assemblage du maillon suivant peut se faire par dessus ou dessous aléatoirement. Généralement le polymère obtenu est par conséquent atactique. Néanmoins en cas d'encombrement (et en œuvrant à basse température), une tendance à la syndiotacticité peut apparaitre (par exemple pour le PMMA).
Les radicaux sont particulièrement réactifs et il faut éliminer toute trace d'oxygène. Il n'est pas indispensable de protéger les groupes fonctionnels le plus fréquemment. De nombreuses réactions parasites sont néanmoins envisageables et il est complexe de contrôler une polymérisation radicalaire (masses molaires, indice de polymolécularité, fins de chaîne... ). Les réactions de transfert au polymère créent des ramifications (possibilité de synthétiser du PEBD par cette méthode), alors que le transfert au monomère ou au solvant diminue le degré moyen de polymérisation. Généralement on ne peut parvenir à des copolymères à blocs par cette méthode.
Amorçage
Cette étape est aussi appelée initiation[1]. Elle comprend deux réactions successives.
La première est la génération de radicaux dits primaires avec une substance dénommée amorceur (ou initiateur). Plusieurs procédés de production de radicaux primaires sont utilisables. On peut distinguer :
- les amorceurs thermiques, générant les radicaux par décomposition thermique, par exemple l'AIBN;
- les amorceurs photochimiques, générant des radicaux sous l'action d'un rayonnement lumineux ou UV, par exemple le benzile;
- les amorceurs redox, pour lesquels la production de radicaux résulte d'une réaction d'oxydo-réduction. Ces derniers sont fréquemment solubles et utilisés dans l'eau, par exemple dans les procédés de polymérisation en émulsion.
Seule une fraction des radicaux constitués amorce effectivement. La production de radicaux doit se faire tout au long de la polymérisation, qui peut durer des heures. On choisis fréquemment le type d'amorceur selon la température à la quelle on peut travailler et en prenant en compte son temps de demi vie.
La seconde réaction est l'addition du radical primaire sur une première unité monomère pour former le premier «maillon» de la chaîne polymère en croissance. C'est en général la première réaction qui forme l'étape lente et gouverne par conséquent la vitesse globale du processus d'amorçage.
Parmi les substances pouvant jouer le rôle d'amorceurs thermiques, les peroxydes présentent une liaison oxygène-oxygène «faible» qui peut subir une réaction de coupure homolytique intramoléculaire sous l'effet de températures modérées, de l'ordre de 90 à 150 °C, ou alors sous l'action d'un rayonnement UV ou suite à une réaction d'oxydoréduction. La totalité des deux réactions obéit au schéma suivant dans le cas d'un monomère vinylique de type CH2=CHR :
- Génération des radicaux primaires :
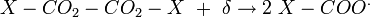
- décarboxylation :
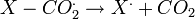
- Addition sur la première unité monomère : ˆ
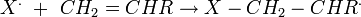
Les peroxydes présentent l'inconvénient d'être instables et quelquefois explosifs. L'AIBN présente l'inconvénient de générer des sous-produits cancérigènes. L'azobisisobutyronitrile (AIBN) est une molécule qui se décompose aisément en diazote (gaz) et en un radical stabilisé par le groupement nitrile.
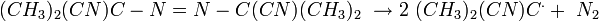
Propagation
La propagation est la principale étape de la polymérisation radicalaire. C'est au cours de cette étape que la chaîne macromoléculaire se forme par addition successive d'unités monomères sur le «macro-radical» en croissance. Le nombre d'occurrence de la réaction de propagation gouverne le degré de polymérisation en nombre de la chaîne constituée et par conséquent la masse molaire du polymère constitué.
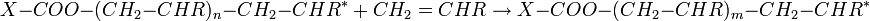 avec m = n+1.
avec m = n+1.
Terminaison
Les réactions de terminaison mettent en jeu deux macro-radicaux en croissance.
Dans le premier cas, la réaction de recombinaison, deux macro-radicaux reconstituent une liaison covalente :
où p = n + m + 2.
Dans le deuxième cas, la réaction de dismutation, les deux macro-radicaux donnent lieu à une réaction de transfert d'hydrogène, suivie d'une recombinaison. Le résultat global peut s'écrire :
La proportion relative de ces deux modes de terminaison dépend principalement du type de monomère employé, de l'accessibilité des sites radicalaires c'est-à-dire de l'encombrement stérique des sites actifs.
Aspect cinétique
| Etape | Réaction | Vitesse associée |
|---|---|---|
|
|
Etape lente :
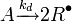 |
|
Etape rapide :
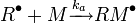 |
![v_a = k_a[Rˆ \bullet][M]](illustrations/467b0e08d5eb901b528d7a1539e1e5ad.png) |
|
|
|
||
|
|
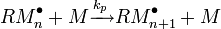 |
![v_p = -\frac {\mathrm{d}[M]} {\mathrm{d}t} = k_p{\color{Tan}[RM_nˆ \bullet]}[M]](illustrations/27c1730c6842911eb3d39a8fcf71ce34.png) |
|
Le temps de demi réaction de la polymérisation : |
||
|
|
Recombinaison :
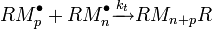 |
![v_t = 2k_t[RM_nˆ \bullet]ˆ2](illustrations/1aa0a60cf9c4a66f005e5acc0f2354ee.png) et si ÆQS : va = vt alors : |
Dismutation :
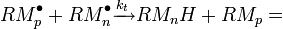 |
||
A est l'amorceur qui se décompose en un composé R, M est le monomère.
En général :
Ces valeurs dépendent de la température via la Loi d'Arrhenius et de la longueur de la chaîne.
On peut aussi introduire la longueur de chaîne cinétique 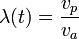 (en absence de transfert). C'est le nombre moyen d'étape de propagation par radical constitué. On sait aussi que cette grandeur est liée au degré moyen de polymérisation DPn :
(en absence de transfert). C'est le nombre moyen d'étape de propagation par radical constitué. On sait aussi que cette grandeur est liée au degré moyen de polymérisation DPn :
- terminaison par dismutation : DPn = λ
- terminaison par recombinaison : DPn = 2λ
On peut ainsi calculer la concentration en monomère à introduire selon le DPn (lié à la masse molaire moyenne) voulu.
Notes et références
- ce qui est un anglicisme
- éléments de cinétique
Voir aussi
- Polymère
- Polymérisation
- Polymérisation en chaîne
- Polymérisation radicalaire par transfert d'atomes
- Effet Trommsdorff
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/12/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

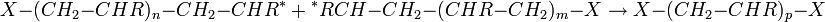
![\textstyle t_{1/2} = \frac {ln(2)} {k_p{\color{Tan}[RM_nˆ \bullet]}}](illustrations/4b8091b88bf03c9d4f9e789a9bf331ca.png)
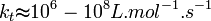
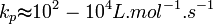
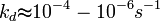

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité